ESTRUCTURA DE HIDRATOS DE CARBONO
Los carbohidratos o hidratos de carbono están formados por carbono (C), hidrógeno (H) y oxígeno (O) con la formula general (CH2O)n. Los carbohidratos incluyen azúcares, almidones, celulosa, y muchos otros compuestos que se encuentran en los organismos vivientes.
Los carbohidratos básicos o azúcares simples se denominan monosacáridos. Azúcares simples pueden combinarse para formar carbohidratos más complejos. Los carbohidratos con dos azúcares simples se llaman disacáridos. Carbohidratos que consisten de dos a diez azúcares simples se llaman oligosacáridos, y los que tienen un número mayor se llaman polisacáridos.
los CHO tienen estructura de polihidroxialdehído o de polihidroxiacetona ademas todos los carbohidratos presentan grupos funcionales C=O o -OH.
el bióxido de carbono reacciona con agua para formar glucosa,con el consecuente desprendimiento del oxigeno por su parte, la glucosa da origen a muchos otros azucares.como la sacarosa y la fructuosa o bien polimeros como la celulosa y el almidon. los organismos obtienen energia atravez del metabolismo bioquimico de los CHO (glucolisis y ciclo de krebs)
Los carbohidratos básicos o azúcares simples se denominan monosacáridos. Azúcares simples pueden combinarse para formar carbohidratos más complejos. Los carbohidratos con dos azúcares simples se llaman disacáridos. Carbohidratos que consisten de dos a diez azúcares simples se llaman oligosacáridos, y los que tienen un número mayor se llaman polisacáridos.
los CHO tienen estructura de polihidroxialdehído o de polihidroxiacetona ademas todos los carbohidratos presentan grupos funcionales C=O o -OH.
el bióxido de carbono reacciona con agua para formar glucosa,con el consecuente desprendimiento del oxigeno por su parte, la glucosa da origen a muchos otros azucares.como la sacarosa y la fructuosa o bien polimeros como la celulosa y el almidon. los organismos obtienen energia atravez del metabolismo bioquimico de los CHO (glucolisis y ciclo de krebs)
CLASIFICACIÓN Y NOMENCLATURA
Existen diversas clasificaciones de los carbohidratos cada una de las cuales se basa en un criterio distinto: estructura química, ubicacion del grupo C=O (aldosas o cetosas), numero de átomos de carbono en la cadena(triosa,tetrosa,pentosa y hexosa), abundancia en la naturaleza, uso en alimentos, poder edulcorante, etc.
por lo general se prefiere el criterio de la estructura química que hace referencia al tamaño de la molécula o al numero de átomos que esta contiene, asi como la cantidad de unidades de azúcar que lo conforman.
de acuerdo con este principio, los hidratos de carbono pueden ser monosacaridos, oligosacaridos y poligosacaridos.
loszúcares son hidratos de carbono generalmente blancos y cristalinos, solubles en agua y con un sabor dulce.
por lo general se prefiere el criterio de la estructura química que hace referencia al tamaño de la molécula o al numero de átomos que esta contiene, asi como la cantidad de unidades de azúcar que lo conforman.
de acuerdo con este principio, los hidratos de carbono pueden ser monosacaridos, oligosacaridos y poligosacaridos.
loszúcares son hidratos de carbono generalmente blancos y cristalinos, solubles en agua y con un sabor dulce.
Clasificación de monosacáridos basado en el número de carbonos
| Número de Carbonos | Categoría | Ejemplos |
|---|---|---|
| 4 | Tetrosa | Eritrosa, Treosa |
| 5 | Pentosa | Arabinosa, Ribosa, Ribulosa, Xilosa, Xilulosa, Lixosa |
| 6 | Hexosa | Alosa, Altrosa, Fructosa, Galactosa, Glucosa, Gulosa, Idosa, Manosa, Sorbosa, Talosa, Tagatosa |
| 7 | Heptosa | Sedoheptulosa, Manoheptulosa |
Las estructuras de los sacáridos se distinguen principalmente por la orientación de los grupos hidroxilos (-OH). Esta pequeña diferencia estructural tiene un gran efecto en las propiedades bioquímicas, las características organolepticas (e.g., sabor), y en las propiedades físicas como el punto de fusión y la rotación específica de la luz polarizada. Un monosacárido de forma lineal que tiene un grupo carbonilo (C=O) en el carbono final formando un aldehído (-CHO) se clasifica como una aldosa. Cuando el grupo carbonilo está en un átomo interior formando una cetona, el monosacárido se clasifica como unacetosa.
Tetrosas
 D-Eritrosa
D-Eritrosa  D-Treosa
D-Treosa
Pentosas
 D-Ribosa
D-Ribosa  D-Arabinosa
D-Arabinosa  D-Xilosa
D-Xilosa  D-Lixosa
D-Lixosa
La forma anular de la ribosa es un componente del ácido ribonucleico (ARN). La desoxirribosa, que se distingue de la ribosa por no tener un oxígeno en la posición 2, es un componente del ácido desoxirribonucleico (ADN). En los ácidos nucleicos, el grupo hidroxilo en el carbono numero 1 se reemplaza con bases nucleótidas.
 ribosa
ribosa  desoxiribosa
desoxiribosaHexosas
Hexosas, como las que están ilustradas aquí, tienen la fórmula molecular C6H12O6. El químico alemán Emil Fischer (1852-1919) identificó los estereoisómeros de estas aldohexosas en 1894. Por este trabajo recibió un Premio Nobel en 1902.
 D-Alosa
D-Alosa  D-Altrosa
D-Altrosa  D-Glucosa
D-Glucosa  D-Manosa
D-Manosa D-Gulosa
D-Gulosa  D-Idosa
D-Idosa  D-Galactosa
D-Galactosa  D-Talosa
D-Talosa
HIDRLOISIS
Hidrólisis es una reacción química entre una molécula de agua y otra molécula, en la cual la molécula de agua se divide y sus átomos pasan a formar parte de otra especie química. Esta reacción es importante por el gran número de contextos en los que el agua actúa como disolvente.
En la hidrólisis ácido-base el agua se divide en el ion hidroxilo OH- y un ion H+ (el cual es inmediatamente hidratado para formar el ion hidronio H3O+).
Esta reacción sucede espontáneamente en agua pura, y en el equilibrio la concentración de iones hidronio en agua es [H3O+] = 1 × 10−7 M. Esta es también la concentración de iones hidroxilo puesto que cada molécula de agua que se divide genera un hidroxilo y un hidronio. Dicho equilibrio se denomina autoprotólisis
Esta reacción sucede espontáneamente en agua pura, y en el equilibrio la concentración de iones hidronio en agua es [H3O+] = 1 × 10−7 M. Esta es también la concentración de iones hidroxilo puesto que cada molécula de agua que se divide genera un hidroxilo y un hidronio. Dicho equilibrio se denomina autoprotólisis
La adición de algunas sustancias al agua, por ejemplo una sal, modifica el equilibrio.1 Al ser disueltos en agua, los iones constituyentes de una sal se combinan con los iones hidronio, hidroxilo, o ambos, procedentes de la disociación del agua. Al consumirse estos iones se modifica su concentración y, como consecuencia, se modifica el valor del pH.
Los iones A-, BH+ procedentes de ácidos débiles AH, bases débiles B o sales AB se hidrolizan por acción del agua, dependiendo el grado de la reacción de la debilidad del ácido o de la base, y la solubilidad de la sal; los iones procedentes de ácidos o bases fuertes no se hidrolizan apreciablemente.
Tanto la reacción como su constante de equilibrio se pueden obtener por combinación de la reacción ácido-base con la reacción de autoprotólisis del agua.
Así, las sales obtenidas a partir de ácidos y bases fuertes no se hidrolizan, las obtenidas a partir de ácidos y bases débiles se hidrolizan de forma que el pH depende de las dos constantes, y en las obtenidas a partir de una combinación de ácido y base en las que solo uno es fuerte, será el fuerte el que determine el pH.
Tanto la reacción como su constante de equilibrio se pueden obtener por combinación de la reacción ácido-base con la reacción de autoprotólisis del agua.
Así, las sales obtenidas a partir de ácidos y bases fuertes no se hidrolizan, las obtenidas a partir de ácidos y bases débiles se hidrolizan de forma que el pH depende de las dos constantes, y en las obtenidas a partir de una combinación de ácido y base en las que solo uno es fuerte, será el fuerte el que determine el pH.
la hidrólisis se presenta como la reacción opuesta a la condensación. En este contexto una molécula orgánica y el agua reaccionan rompiendo un enlace covalente para formar dos moléculas orgánicas con grupos funcionales que incluyen los átomos de la molécula de agua. En general se requiere añadir ácidos o bases fuertes para catalizar la hidrólisis.

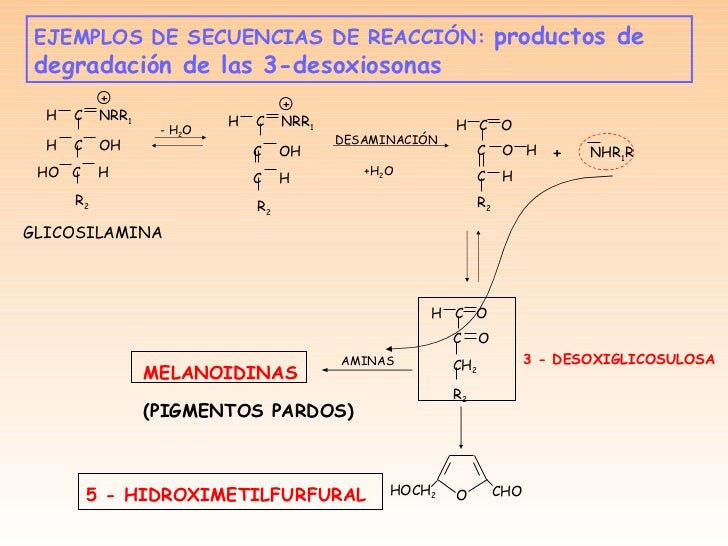
REACCIONES DE DESHIDRATACIÓN Y DEGRADACIÓN
Son reacciones de gran relevancia en los alimentos, son
catalizadas por ácidos o bases y muchas reacciones de este tipo son de
β
– eliminación.Pentosas: 2 – furaldehído como
principalHexosas: 5 – hidroxiacetil – 2 – furaldehído (HMF)2 –
hidroxiacetilfuranoIsomaltolAlgunos de estos productos de degradación
poseen intenso olor y pueden conferir por tanto fuertes
aromas tanto deseables como no deseables.El 2 – furaldehido y HMF se producen
en zumos de frutas procesados térmicamente.La reacción de
β
- eliminación puede continuar con la forma enólica de la 3 –
desoxiglucosona. El azúcar cis – 3.4 – eno puede sufrir entonces una ciclación
ydeshidratación para dar lugar a HMF.Las reacciones térmicas que inducen la
rotura de enlaces carbono – carbono danlugar como productos primarios a ácidos,
aldehídos, cetonas,..., furano, CO, CO
2
(volátiles).Se
identifican por la cromatografía de gases (CG) o la combinación de esta
técnicacon la espectrometría de masas (CG – EM).
Reacción de Maillard (PARDEAMIENTO NO ENZIMATICO)
Azúcar reductor + Compuestos aminosInicio de la reacción de
MaillardRearreglo de AmadoriReacción de Maillard AvanzadaFusión Deshidratación
Degradación deStreker
Dicarbonilos
Dicarbonilos +Piridina aminoácidos + aldehídos + creatinina
Formación de Melanoidinas (pigmentos oscuros)
El procesoEl grupo de carbonil del azúcar reacciona con el
grupo amino del aminoácido,se produce una glicosamina n-sustituida y agua.
La glicosalamina inestable experimenta el cambio de Amadori, formandocetosaminas.Hay varias maneras para que las cetosaminas reaccionen más:Agua y reductonas. Diacetilo, aspirina, piridin aldehido y otro de cadena cortahidrolítico pueden ser formados, productos de la fusión.Polímeros nitrogenados marrones producen melanoidinas.Factores
La glicosalamina inestable experimenta el cambio de Amadori, formandocetosaminas.Hay varias maneras para que las cetosaminas reaccionen más:Agua y reductonas. Diacetilo, aspirina, piridin aldehido y otro de cadena cortahidrolítico pueden ser formados, productos de la fusión.Polímeros nitrogenados marrones producen melanoidinas.Factores
La alta temperatura, humedad baja favorecen la reacción.La
reacción del Maillard es perceptible alrededor de 155 °CLas condiciones
alcalinas promueven la reacción de Maillard.
El índice de las reacciones del Maillard aumenta como el incremento de laactividad de agua, alcanzando un máximo en las actividades de agua en elrango de 0.6 a 0.7. Sin embargo, como la reacción del Maillard produce elagua, aumentos posteriores en actividad de agua pueden inhibir reacciones delMaillard.
Los azúcares pentosas reaccionan más que las hexosas, que reaccionan másque disacáridos. Diversos aminoácidos producen diversas proporciones depardeamiento.
El índice de las reacciones del Maillard aumenta como el incremento de laactividad de agua, alcanzando un máximo en las actividades de agua en elrango de 0.6 a 0.7. Sin embargo, como la reacción del Maillard produce elagua, aumentos posteriores en actividad de agua pueden inhibir reacciones delMaillard.
Los azúcares pentosas reaccionan más que las hexosas, que reaccionan másque disacáridos. Diversos aminoácidos producen diversas proporciones depardeamiento.

FUNCIÓN DE LOS MONOSACARIDOS EN LOS ALIMENTOS
Valor relativo que mide la capacidad de una sustancia de provocar sabor dulce en relación al dulzor de una solución de sacarosa en condiciones normalizadas y a la que se le atribuye el valor 100.
La sacarosa se toma como sustancia de referencia para clasificar el poder edulcorante de distintas sustancias. En la siguiente tabla se resume el poder edulcorante de distintos compuestos:
HIDROFILIA Y EFECTO CRIOPROTECTOR
la hidrofilia se debe a la presencia de numerosos grupos hidroxilos que interaccionan con las moléculas de agua mediante la formación de enlaces de hidrogeno, lo que conduce a la solubilizacion de los azucares y de varios de sus polímeros la estructura del carbohidrato afecta la capacidad hidrofilica.
ESPESANTES Y ESTABILIZANTES
Estas sustancias se utilizan para conferir al producto final de unas determinadas propiedades sensoriales como lahinchazón del producto, dotarlo de viscosidad o estabilizar espumas o natas en fases de distinta polaridad. Estas sustancias se suelen aplicar en productos dietéticos, puesto que no tienen valor nutricional. Algunas de lasgomas se obtienen como productos de resinas o de semillas. En algunos casos, se han asociado efectosbeneficiosos de estos compuestos sobre los niveles de colesterol.



No hay comentarios:
Publicar un comentario